Na área química, a catálise é definida como o aumento da velocidade de uma reação química na presença de uma substância química sem resultar em mudanças permanentes. Ou seja, sua função é apenas aumentar a velocidade com que os reagentes se transformam em produtos sem serem consumidos e sem alterar o equilíbrio termodinâmico.
A essas substâncias damos o nome de catalisador.
Nessas reações, há uma adsorção transitória dos reagentes na superfície dos centros ativos do catalisador e em seguida desorção dos produtos.
A+X -> AX
AX -> BX
BX -> B+X
E qual será sua importância?
Bem, os catalisadores são empregados a mais de 2000 anos. Sua primeira utilização foi na produção de queijo e vinhos. Ainda, dentro do nosso próprio corpo possuímos catalisadores.
Atualmente, cerca de 70% dos processos na Indústria Química lançam mão de catalisadores, por exemplo, no refino de petróleo empregando zeólitas como catalisadores.
Com o passar do tempo, a indústria vem buscando formas de desenvolver novos catalisadores. Como resultado, haverá um melhor aproveitamento de matéria prima, isso quer dizer, menos desperdício, menos investimento , consequentemente menor necessidade de tratar os efluentes.
Analogamente, o desenvolvimento de novos catalisadores promoverá uma ampliação no leque de escolha da matéria prima. Isso quer dizer, muitas rotas são deixadas de lado devido ao tempo que levará para obter o produto desejado.
Mas só através dos catalisadores podemos mudar a taxa da reação Vejamos!
Velocidade da reação
Antes de começarmos, vamos relembrar a equação da taxa de reação.
Contudo, k é calculada pela equação de Arrhenius:
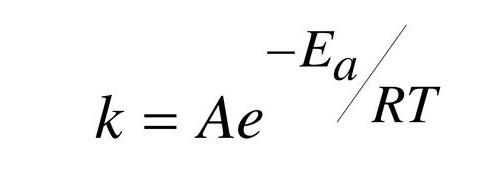
Então, como fazer para aumentar a taxa de reação?
Analisando a equação, nós podemos aumentar, sem a utilização de catalisadores, de três formas. Para isso só basta alterarmos a temperatura, concentração ou a pressão. Todavia, será que é viável? Vamos analisar termo a termo.
Primeiramente, olhando para a temperatura, podemos citar como pontos negativos um maior gasto de energia. Ainda, esse aumento de temperatura pode levar ao desencadeamento de reações secundárias, obtendo assim uma maior formação de produtos indesejados.
Segundo, um aumento da concentração dos reagentes requer a construção de reatores mais resistentes e formação de reações secundárias. Ainda, uma reação com o aumento do volume desloca o equilíbrio da reação para os reagentes (gases).
Analogamente, um aumento da pressão requer a construção de reatores mais resistentes. Entretanto, como os catalisadores afetam a cinética da reação.
A presença dos catalisadores no sistema reacional faz com que haja uma redução da energia de ativação da reação, podendo ser ilustrado com a imagem abaixo.
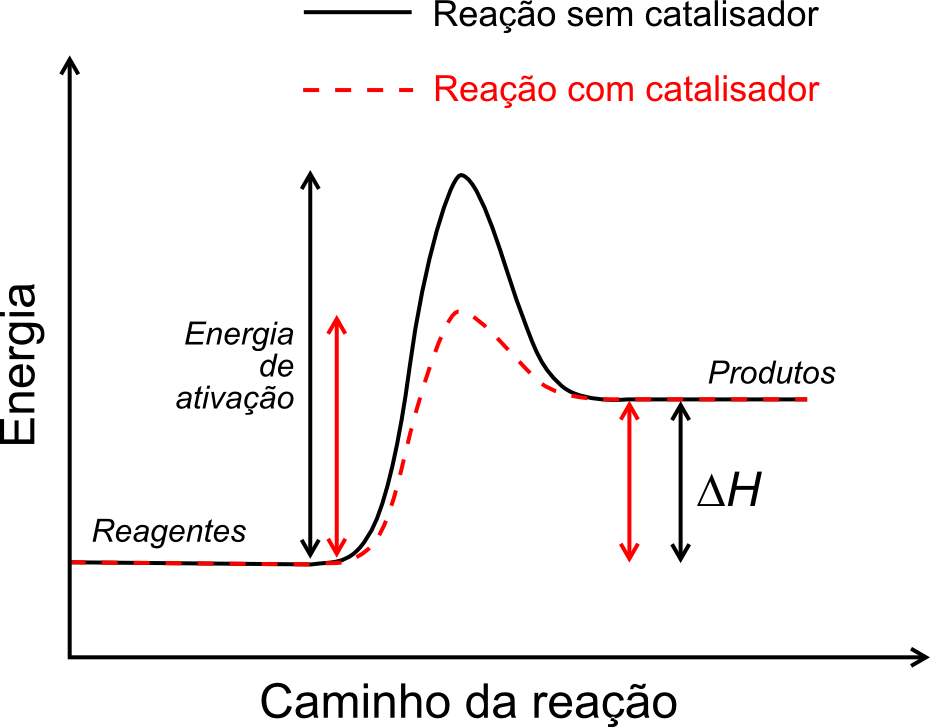
Ah então os catalisadores são sempre a solução? Não! Também possuímos problemas com os catalisadores. Essas espécies podem sofrer desativação. Sendo assim, constantemente faz-se necessário regenerar o catalisador.
Processos químicos e a catálise
Os processos químicos catalisados podem ocorrer em dois sistemas diferentes. Quando catalisadores e reagentes estão na mesma fase, dizemos que a catálise é homogênea.
Em contrapartida, quando a reação ocorre com catalisadores e reagentes em fases diferentes, por exemplo, um catalisador sólido e os reagentes na fase gasosa, dizemos que a catálise é heterogênea.
Por fim, vamos ver a comparação entre os tipos de catálise ilustrada pela imagem abaixo.

O processo de catálise
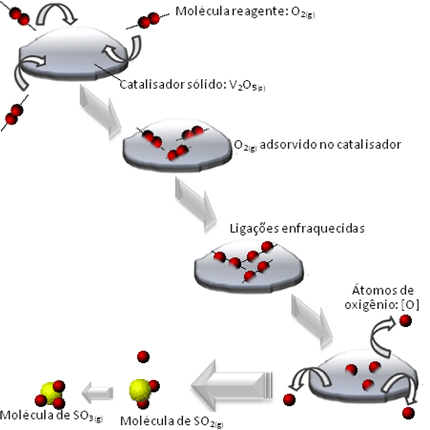
Conforme dito anteriormente, para que transformemos uma matéria prima em produtos na presença de um catalisador, faz-se necessário que haja uma adsorção do reagente na superfície do catalisador.
Por sua vez, essa adsorção pode ocorrer de duas formas:
Na adsorção física, o reagente se liga à matéria prima devido às forças de interação do tipo Van der Waals. Logo, não há alteração química das moléculas adsorvidas.
Em oposição, na adsorção química, temos a formação de ligações químicas. Temos que salientar que esse processo é exotérmico.
Brevemente, em um outro artigo abordaremos sobre os catalisadores de forma mais aprofundada. Serão apresentados suas propriedades, desativação, preparação e muito mais.
Em suma, continuem acompanhando o blog da engenharia no site e nas redes sociais para não perderem nenhum conteúdo.
Até breve!